ISO 13485ほか、医療機器関連規格
第1回
ISO/TC210とISO 13485の概要
0.はじめに
ISO/TC210では、医療機器の品質マネジメントシステム規格であるISO 13485や、医療機器のリスクマネジメント規格であるISO 14971など日本をはじめとして各国の医療機器規制に用いられている国際規格を取り扱っている。
今回のコラムでは、ISO/TC210の概要とISO 13485についてご紹介したい。
1.ISO/TC210(医療機器の品質マネジメント及び関連する一般事項)について
ISO/TC210は、医療機器の品質システム規制の整合化のため、医療機器の品質マネジメントシステムの国際規格の作成が求められて、1994年に設立された。
現在の議長は、Peter Linders氏(オランダ、フィリップス社)であり、事務局は、AAMI(米国)である。
現在、投票権を持つPメンバーは、42カ国、また、オブザーバーとして参加するPメンバーは21カ国である。
ISO/TC210は、設立当初はWG1からWG4の4つの作業班(WG/Working Group)で構成されていたが医療機器のリスク分析を取り扱っていたWG4は、
その後IECとの合同作業班(JWG/Joint Working Group)としてJWG1となった。そのため、WG4はない。
現在は、IEC/SC62A、IEC/62Dとの合同作業班を含めて、以下の9つの作業班と2つのAdHoc グループ、1つのタスクフォースで構成される。
◎WG1 品質システムの医療機器への適用
◎WG2 医療機器の品質規格から生じる一般的事項
◎WG3 医療機器の図記号、用語
◎WG5 リザーバーデリバリーシステム
◎WG6 医療機器の市販後監視
◎JWG1 医療機器へのリスクマネジメントの適用(IEC/SC62AとのジョイントWG)
◎JWG2 医療機器ソフトウエア(IEC/SC62AとのジョイントWG)
◎JWG3 医療機器のユーザビリティ(IEC/SC62AとのジョイントWG)
◎JWG4 スモールボアコネクタ(IEC/SC62DとのジョイントWG)
◎AHG1 品質マネジメントシステムの上位構造(HLS)に関するアドホックグループ
◎AHG2 スモールボアコネクタの色分けに関するアドホックグループ
◎SPTF スペイン語翻訳タスクフォース
このうち、スモールボアコネクタに関するJWG4に関しては、元々の活動範囲とは異なるが2007年の総会でISO/TC210の活動範囲が改訂され正式に設置された。
また、WG5は、JWG4より2012年に分離した。WG6は2016年に正式に決議され設置された。現在のISO/TC210の活動範囲は以下である。
<ISO/TC210の活動範囲>
医療機器の品質マネジメントと関連する一般事項に関する領域における要求事項とガイダンスの標準化。スモールボアコネクタに関する規格。
なお、以下の内容を除外している。
- ISO/TC176で取り扱われる一般的品質マネジメント規格
- 医薬品の品質マネジメント規格
- 特定の医療機器に対する技術的要求事項(注:スモールボアコネクタは医療機器の部品であるが、それ自体は医療機器ではない)
ISO/TC210の日本国内での活動は、日本医療機器産業連合会(医機連)のISO/TC210国内対策委員会が取りまとめISO/TC210設置当初からPメンバーとして積極的に活動を行っている。
現在、東京大学大学院 鄭教授に委員長をお願いしている。本委員会の下にISO/TC210と同じ構造で、各WGに相当する分科会が構成され活動を行っている。
また、日本医療機器産業連合会では、国際規格活動推進委員会を組織してISO/TC210をはじめとして医療機器の国際規格の活動に関してサポートを行っている。
2.ISO 13485について
ISO 13485は、品質マネジメントシステム(QMS)規格及びそのガイダンスの作成を目的としてISO/TC210/WG1により作成されている。
図1は、QMS規格の歴史を示している。あわせて、本図ではISO/TC210/WG1の作成規格を示している。
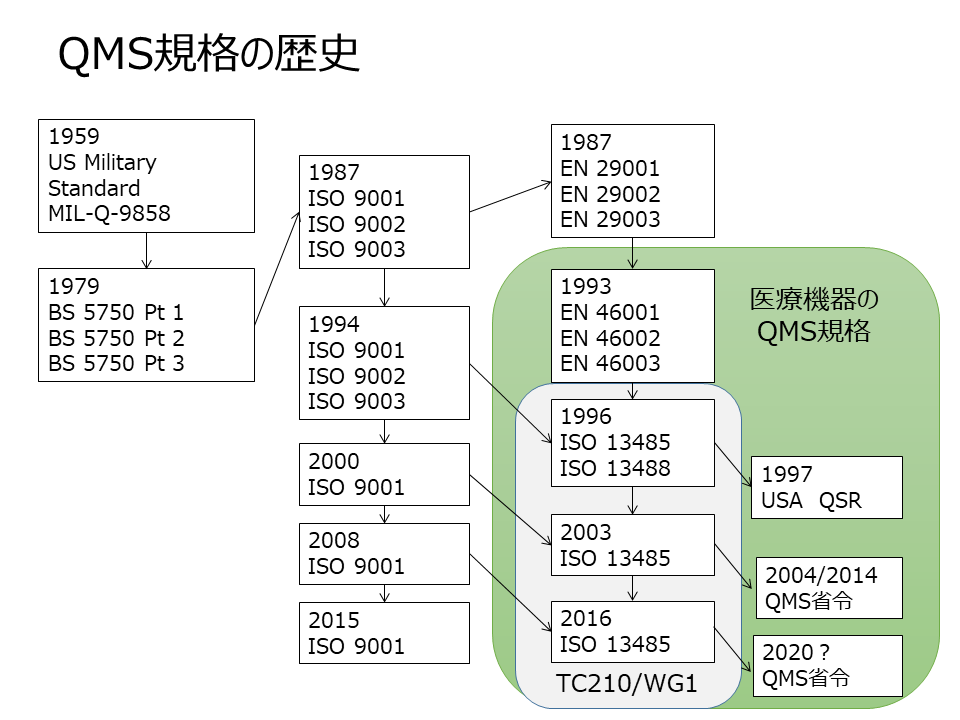
図1 QMS規格の歴史
ISO/TC210/WG1の主たる活動はISO 13485-QMS規格の制定である。
本規格は、最初ISO 9001/9002:1994及び欧州の医療機器のQMS整合規格であったEN46000シリーズに基づき医療機器の特別要求事項を盛り込んだ
QMS規格としてISO 13485:1998/ISO 13488:1998として完成した。
その後、ISO 9001:2000に整合するように改訂されISO 13485:2003が作成された。
ISO 13488:1996は設計管理を除外していたが、ISO 13485:2003では、ISO 9001:2000の形態を踏襲し、規格の中で設計管理の除外を認める形となった。
ISO 13485:2003では、行政と業界との法規制の国際整合のための集まりであるGHTF(Global Harmonization Task Force)とのMOUに基づきGHTF/SG3(QMS)との合同での開発を進め、各国の医療機器規制に用いるように、表題にも“規制目的の”と明記された。
さらに、これまでの経験から要求事項の明確化と各国規制との整合を考えて改訂が行われISO 13485:2016が発行され、各国の規制に採用されている。
日本では、JIS Q 13485:2018として発行された。
また、QMS省令もISO 13485:2016に合わせることが検討されISO 13485:2016に準拠した改正QMS省令が今年施行の予定である。
ISO 13485:2016は、カナダやオーストラリアでは、このまま規制上の強制規格として採用されており、欧州では、EN ISO 13485:2016として採用されている。
米国においても、ISO 13485は医療機器品質システム規則(QSR)のベースとなっており、現在ISO 13485:2016にあわせて書き直される予定である。
医療機器行政機関の集まりであるIMDRFでは、QMSに関する監査の共通化を目指してMDSAP(Medical Device Single Audit Program)を立ち上げており、すでに米国、ブラジル、カナダ、オーストラリア、日本の5カ国が参加し推進している。
ISO 13485が、各国規制の共通の要求事項となり、このMDSAPの推進に大きな役割を果たしている。
ISO 13485:2016に対するガイダンス文書に関しては、ISO/TR14969の改訂の形でのISO規格の形での発行に時間がかかることから、ISOハンドブック(書籍)の形での発行を進めており、ISO 13485:2016 - Medical Devices - A Practical Guideとして発行されている。
本ガイダンス文書は、日本規格協会より『ISO 13485:2016-医療機器-実践ガイド』として和訳版が発行されており、医療機器のQMSのみならず、他の産業におけるQMSのガイダンスとしても参考になるものであると考える。
なお、ISO 13495:2016は、昨年システマティックレビュー投票が行われ、引き続き利用することが決議されている。
以上
【執筆者】
(一社)日本医療機器産業連合会
ISO/TC210 国内対策委員会 副委員長
(株)日立ハイテクサイエンス
品質保証本部
浅井 英規
第2回以降、ISO 14971-リスクマネジメント、ソフトウエア等のテーマを予定しています。
【規格発行情報】
★「ISO 13485:2016 医療機器-品質マネジメントシステム-規制目的のための要求事項」は、ISOにてオンラインによる無料公開されています。詳細はこちら★
★「ISO 10993シリーズ 医療機器の生物学的評価」の邦訳版も発行しております。詳細は、こちらをご覧ください。★
